แก๊ส คืออะไร
แก๊ส เป็นสถานะอย่างหนึ่งของสสาร ลักษณะของแก๊สจะไม่มีรูปร่างหรือปริมาตรที่แน่นอน มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย ทำให้มีการฟุ้งกระจาย เพราะโมเลกุลเคลื่อนที่ด้วยความเร็วและไม่มีทิศทางที่แน่นอน เมื่อเคลื่อนที่ไปชนกับผนังภาชนะ จะทำให้เกิดความดัน สามารถถูกอัดได้ง่ายและมากกว่าของเหลว ถ้าแก๊สมีการเปลี่ยนอุณหภูมิและความดันก็จะทำให้ปริมาตรเกิดการเปลี่ยนแปลง โดยปริมาตรของแก๊สจะแปลผกผันกับความดันที่มากระทำ และเมื่อนำแก๊สหลายชนิดมาใส่ในภาชนะเดียวกัน ก็จะเกิดการรวมกันเป็นเนื้อเดียวอย่างสมบูรณ์
สมบัติของแก๊ส
1. แก๊สมีรูปร่างเป็นปริมาตรไม่แน่นอน เปลี่ยนแปลงไปตามภาชนะที่บรรจุ เมื่อบรรจุในภาชนะใดก็จะมีรูปร่างเป็นปริมาตรตามภาชนะนั้น เช่น ถ้าบรรจุในภาชนะทรงกลมขนาด 1 ลิตร แก๊สจะมีรูปร่างเป็นทรงกลม ซึ่งมีมีปริมาตร 1 ลิตร นั่นเป็นเพราะแก็สมีแรงยึดเหนี่ยวระหว่างอนุภาค (โมเลกุลหรืออะตอม) น้อยมาก จึงทำให้อนุภาคของแก๊สสามารถเคลื่อนที่หรือแพร่กระจายเต็มภาชนะที่บรรจุนั่นเอง
2. ถ้าให้แก๊สอยู่ในภาชนะที่เปลี่ยนแปลงปริมาตรได้ ปริมาตรของแก๊สจะขึ้นอยู่กับอุณหภูมิ ความดันและจำนวนโมล ดังนั้น เมื่อบอกปริมาตรของแก๊ส ก็จะต้องบอกอุณหภูมิ ความดันและจำนวนโมลด้วย เช่น แก๊สออกซิเจน 1 โมลมีปริมาตร 22.4 dm3;ที่อุณหภูมิ 0 C ความดัน 1บรรยากาศ (STP)
3. สารที่อยู่ในสถานะแก๊สมีความหนาแน่นน้อยกว่าเมื่ออยู่ในสถานะของเหลวและของแข็งมาก เช่น ไอน้ำ มีความหนาแน่น 0.0006 g/cm3 แต่น้ำมีความแน่นถึง 0.9584 g/cm3;ที่100 C
4. เนื่องจากแก็สมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยกว่าของเหลวและของแข็ง ดังนั้น แก๊สจึงสามารถแพร่ได้และแพร่ได้เร็วด้วย
5. เมื่อนำแก็สต่างๆ ตั้งแต่ 2 ชนิดขึ้นไปมาใส่ในภาชนะเดียวกัน แก๊สแต่ละชนิดจะแพร่ผสมกันอย่างสมบูรณ์ทุกส่วน นั่นคือ ส่วนผสมของแก๊สจะเป็นสารเดียวหรือเป็นสารละลาย (Solution)
6. แก๊สส่วนใหญ่ไม่มีสีและโปร่งใส่ เช่น แก๊สออกซิเจน (O2), แก๊สไฮโดเจน (H2), แก๊สคาร์บอนไดออกไซด์ (CO2) แต่แก๊สบางชนิดก็มีสี เช่น แก๊สไนโตเจนไดออกไซด์ (NO2) มีสีน้ำตาลแดง แก๊สคลอรีน (Cl2) มีสีเขียวแกมเหลือง หรือแก๊สโอโซน (O3) ที่บริสุทธิ์จะมีสีน้ำเงินเข้ม เป็นต้น
ประเภทของแก๊ส
สามารถแบ่งออกได้เป็น 2 ประเภท คือ แก๊สอุดมคติ (Ideal gas) และ แก๊สจริง (Real gas) ดังนี้
- แก๊สอุดมคติ (Ideal gas) หรือแก๊สสมบูรณ์ ซึ่งก็คือ แก๊สที่ไม่มีอยู่จริง แต่เป็นสิ่งที่นักวิทยาศาสตร์กำหนดขึ้นเพื่ออธิบายสมบัติต่าง ๆ ที่เกี่ยวกับแก๊ส โดยให้มีพฤติกรรมเป็นไปตามกฎของแก๊สไม่ว่าที่อุณหภูมิหรือความดันใด แก๊สสมบูรณ์เป็นแก๊สที่ไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุล
- แก๊สจริง (Real gas) คือ แก๊สที่ไม่เป็นไปตามกฎต่าง ๆ ของแก๊สสมบูรณ์ ซึ่งเป็นแก๊สที่มีอยู่จริงในธรรมชาติ มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย แต่ในบางสภาวะแก๊สจริงอาจมีสมบัติใกล้เคียงกับแก๊สสมบูรณ์ได้
ตัวแปรที่สำคัญของแก๊ส
1. ปริมาตรของแก๊ส (Volume ; V)
จากการที่โมเลกุลของแก๊สนั้นมีการเคลื่อนที่อย่างอิสระ อีกทั้งยังมีการฟุ้งกระจายจนเต็มภาชนะที่บรรจุ ดังนั้น “ปริมาตรของแก๊ส จึงหมายถึงปริมาตรของภาชนะที่บรรจุแก๊สนั้น ๆ” ซึ่งหน่วยของปริมาตรที่เป็นหน่วย SI คือ ลูกบาศก์เดซิเมตร, ลูกบาศก์เซนติเมตร และลูกบาศก์เมตร
2. อุณหภูมิ (Temperature; T)
เป็นมาตราส่วนที่ใช้บอกระดับความร้อน-เย็นของสาร แต่อุณหภูมิไม่ได้บอกให้ทราบถึงปริมาตรความร้อนของสาร กล่าวคือ สารที่มีอุณหภูมิเท่ากันแสดงว่ามีระดับความร้อนเท่ากันแต่อาจจะมีปริมาตรความร้อนเท่ากันก็ได้ เครื่องมือวัดอุณหภูมิที่ใช้กันอย่างแพร่หลายคือเทอร์โมมิเตอร์ ส่วนหน่วยของอุณหภูมิมีหลายแบบ ขึ้นกับเครื่องมือที่ใช้วัด เช่น องศาเซลเซียส, องศา ฟาเรนไฮด์ และ เคลวิน (K) เป็นต้น อย่างไรก็ตาม ในการศึกษาเกี่ยวกับแก๊ส จะนิยมใช้หน่วย เคลวิน ซึ่งมีความสัมพันธ์กับหน่วยองศาเซลเซียส คือ K = 273.15 + องศาเซลเซียส
3. ความดัน (Pressure; P)
คือ แรงกระทำต่อหน่วยพื้นที่ ถ้าแก๊สบรรจุในภาชนะ ความดันของแก๊สจะเกิดจากการที่โมเลกุลของแก๊สเคลื่อนที่ไปชนผนังภาชนะบรรจุ หน่วยของความดันของแก๊สมีหลายหน่วย เช่น นิวตันต่อตารางเมตร, ไดน์ต่อตารางเซนติเมตร, ปอนด์ต่อตารางนิ้ว, มิลลิเมตรปรอท, ทอรร์ (Torr), บรรยากาศ (atm), พีเอสไอ (psi) และปาสคาล (Pa) ซึ่งในแต่ละหน่วยมีความสัมพันธ์กันดังนี้
ความดันที่เกิดจากมวลของปรอทในหลอดแก้วเหนือระดับปรอทในอ่าง สามารถคำนณได้โดยใช้สูตร
ความดัน = แรง / พื้นที่
โดยกำหนดให้ P คือ ความดัน และ A คือ พื้นที่
P = F/A
จากกฎของนิวตัน F = ma เมื่อ m คือ มวล และ g คือ ความเร่งเนื่องจากแรงโน้มถ่วงของโลก แทนค่า F ในสูตรข้างต้นจะได้ว่า
P = mg/A
จาก D = m/v ; m = DV
แทนค่า m จะได้ว่า P = DVg/A โดย

จากสมการ ดังกล่าว จะเห้นได้ว่า D และ g เป็นค่าคงที่ ดังนั้น ความดันจึงแปรผันโดยตรงกับความสูงของปรอทในหลอดแก้ว
เครื่องมือที่ใช้วัดความดันของแก๊ส คือ แมนอมิเตอร์ ซึ่งมีแบบปลายเปิด ดังรูป ก. และแบบปลายปิด ดังรูป ข.
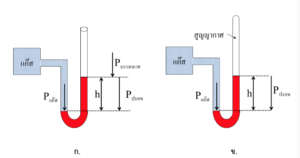
แมนอมิเตอร์ ชนิดปลายเปิด สามารถหาความดันของแก๊สได้จาก P แก๊ส = P บรรยากาศ + P ปรอท
และจากสมการ ค่าความดันบรรยากาศที่อ่านค่าได้จากบารอมิเตอร์ และความดันเนื่องจากความสูงของปรอท h สามารถคำนวณได้จากสมการ P = Dgh จากรูป ก. ถ้าระดับปรอทที่ต่ออยู่กับแก๊ส สูงกว่าระดับปรอททางปลายเปิด แสดงว่าความดันของแก๊สน้อยกว่าความดันบรรยากาศ จะได้เป็น P แก๊ส = P บรรยากาศ – P ปรอท
แมนอมิเตอร์ชนิดปลายปิด ถ้าลำปรอทในหลอดแก้วปลายปิด สูงกว่าระดับปรอทที่ต่ออยู่กับแก๊สเท่ากับ h ความดันของแก๊สจะเท่ากับความดันเนื่องจากปรอทสูงเท่ากับ h และจะได้ว่า Pแก๊ส = Pปรอท
ซึ่งในความเป็นจริงแล้ว ปรอทจะมีความดันไอ แต่เนื่องจากความดันไอของปรอทมีค่าน้อยมาก จึงไม่คิดค่าความดันไอของปรอท
ตัวอย่างข้อสอบ แก๊สและสมบัติของแก๊ส
1. ความหนาแน่นของปรอทและน้ํามันข้าวโพดมีค่า 13.5 และ 0.92 g/mL ตามลําดับ หากใช้น้ํามันข้าวโพดแทนปรอทในบารอมิเตอร์อยากทราบว่าที่ความดันบรรยากาศมาตรฐาน (standard atmospheric pressure) ลําของน้ํามันจะสูงกี่เมตร สมมติว่าค่าความดันไอของน้ํามันข้าวโพดน้อยมาก
2. จงหาปริมาตรในหน่วยลิตร (L) ที่ STP ของแก๊ส HCl 54.75 กรัม
3. แก๊ส Ar เป็นแก๊สเฉื่อยที่ใช้ยับยั้งการระเหยของไส้หลอดไฟ ถ้าหลอดไฟ 1 ดวงบรรจุแก๊ส Ar ความดัน 1.20 atm ที่อุณหภูมิ 18 °C ถูกทําให้สว่างที่อุณหภูมิ 85 °C โดยที่หลอดไฟมีขนาดคงที่ จงหาความดันของแก๊ส Ar (atm) เมื่อหลอดไฟสว่าง
4. ภาชนะใบหนึ่งมีขนาด 2.10 L บรรจุแก๊ส A หนัก 4.65 กรัม ที่ความดัน 1.00 atm และอุณหภูมิ 27 °C จงหามวล โมเลกุลของแก๊ส A
5. แก๊สธรรมชาติประกอบด้วย 8.24 โมล CH4, 0.421 โมล C2H6 และ 0.116 โมล C3H8 ถ้าความดันแก๊สรวมมีค่า เท่ากับ 1.37 atm จงหาความดันย่อยของ propane (C3H8)