สรุปเนื้อหา ของแข็ง ของเหลว แก๊ส คืออะไร
ของแข็ง ของเหลว แก๊ส คือ สถานะของสาร ซึ่งสารในธรรมชาตินั้นจะแบ่งออกเป็น 3 สถานะนี้ ได้แก่
1. ของแข็ง เป็นสถานะที่อนุภาคจะอยู่ชิดกัน และไม่สามารถเคลื่อนที่ได้ ทำให้แรงยึดเหนี่ยวอนุภาคสูงกว่าสารเดียวกันในสถานะอื่น ๆ นอกจากนี้ยังมีรูปร่างและปริมาตรคงที่แน่นอน ไม่เปลี่ยนแปลงไปตามรูปทรงของภาชนะที่บรรจุ ตัวอย่างของสารที่มีสถานะเป็นของแข็ง เช่น เหล็ก อะลูมิเนียม ทองแดง เงิน เป็นต้น
2. ของเหลว เป็นสถานะที่อนุภาคอยู่ห่างกันเล็กน้อย ทำให้อนุภาคสามารถเคลื่อนที่ได้ รูปร่างไม่แน่นอน โดยจะเปลี่ยนตามภาชนะที่บรรจุ แต่ปริมาตรไม่ขึ้นกับภาชนะ ตัวอย่างของสารที่มีสถานะเป็นของเหลว เช่น น้ำ แอลกอฮอล์ โบรมีน เป็นต้น
3. แก๊ส เป็นสถานะที่อนุภาคจะอยู่ห่างกัน แรงยึดเหนี่ยวมีค่าน้อย ทำให้เคลื่อนที่ได้มาก อีกทั้งยังมีปริมาตรและรูปร่างตามภาชนะที่บรรจุ ตัวอย่างของสารที่มีสถานะเป็นแก๊ส เช่น แก๊สออกซิเจน แก๊สไฮโดรเจน แก๊สคาร์บอนไดออกไซด์ แก๊สไนโตรเจน เป็นต้น ทั้งนี้ แก๊สยังสามารถแบ่งออกได้เป็น 2 ประเภท ได้แก่
- แก๊สอุดมคติ (Ideal gas) หรือแก๊สสมบูรณ์ ซึ่งก็คือ แก๊สที่ไม่มีอยู่จริง แต่เป็นสิ่งที่นักวิทยาศาสตร์กำหนดขึ้นเพื่ออธิบายสมบัติต่าง ๆ ที่เกี่ยวกับแก๊ส โดยให้มีพฤติกรรมเป็นไปตามกฎของแก๊สไม่ว่าที่อุณหภูมิหรือความดันใด แก๊สสมบูรณ์เป็นแก๊สที่ไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุล
- แก๊สจริง (Real gas) คือ แก๊สที่ไม่เป็นไปตามกฎต่าง ๆ ของแก๊สสมบูรณ์ ซึ่งเป็นแก๊สที่มีอยู่จริงในธรรมชาติ มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย แต่ในบางสภาวะแก๊สจริงอาจมีสมบัติใกล้เคียงกับแก๊สสมบูรณ์ได้
ทฤษฎีจลน์ของแก๊ส
เป็นทฤษฎีที่ตั้งขึ้นเพื่อใช้อธิบายกฎ ปรากฏการณ์ หรือผลการทดลองที่เกี่ยวกับแก๊ส และพฤติกรรมของแก๊ส
- แก๊สประกอบด้วยอนุภาคจำนวนมากและมีขนาดเล็กมาก จนถือได้ว่าอนุภาคของแก๊สไม่มีปริมาตรเมื่อเทียบกับขนาดภาชนะที่บรรจุ
- โมเลกุลของแก๊สอยู่ห่างกันมาก ทำให้แรงดึงดูดและแรงผลักระหว่างโมเลกุลน้อยมาก จนถือได้ว่าไม่มีแรงกระทำต่อกัน
- โมเลกุลของแก๊สเคลื่อนที่อย่างรวดเร็วในแนวเส้นตรง เป็นอิสระ ด้วยอัตราเร็วคงที่ และไม่เป็นระเบียบ จนกระทั่งชนกับโมเลกุลอื่น ๆ หรือชนกับผนังภาชนะจึงจะเปลี่ยนทิศทางและอัตราเร็ว
- โมเลกุลของแก๊สที่ชนกันเองหรือชนกับผนังภาชนะจะเกิดการถ่ายโอนพลังงานให้แก่กันได้ แต่พลังงานรวมของระบบคงที่
- ณ อุณหภูมิเดียวกัน โมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่ด้วยอัตราเร็วไม่เท่ากัน แต่จะมีพลังงานจลน์เฉลี่ยเท่ากัน โดยที่พลังงานจลน์เฉลี่ยของแก๊สจะแปรผันตรงกับอุณหภูมิเคลวิน
แก๊สที่มีสมบัติเป็นไปตามทฤษฎีจลน์ของแก๊สทุกประการเรียกว่า แก๊สอุดมคติ (Ideal gas) โดยปกติแก๊สทั่วไปจะมีสมบัติเคียงกับแก๊สอุดมคติเท่านั้น สำหรับแก๊สที่มีอนุภาคขนาดเล็ก เมื่อควบคุมให้อยู่ในภาวะที่มีปริมาตรมาก ความดันต่ำ และอุณหภูมิสูง จะมีสมบัติใกล้เคียงกับแก๊สอุดมคติมากขึ้น โดยเฉพาะแก๊สเฉื่อยจะมีสมบัติใกล้เคียงกับแก๊สอุดมคติมากจนอาจจัดเป็นแก๊สอุดมคติได้
นอกจากนี้ สำหรับสถานะของสารแล้ว ในบางครั้งเราอาจจะนับพลาสมา (แก๊สในสภาพที่มีประจุ) ผลึกเหลว (Liquid crystal) และเกลือหลอมเหลว (Molten salt state) เป็นสถานะเพิ่มเติมด้วยก็ได้เช่นกัน
การเปลี่ยนแปลงสถานะของสารมีรูปแบบ ดังนี้
- การหลอมเหลว (Melting) คือ การที่สารเปลี่ยนสถานะจากของแข็งเป็นของเหลว โดยต้องให้ความร้อน ทำให้อนุภาคเอาชนะแรงยึดเหนี่ยวได้ ณ อุณหภูมิที่เรียกว่า จุดหลอมเหลว (Melting Point) เป็นค่าคงที่ของสารหนึ่งๆ เท่านั้น
- การกลายเป็นไอ (Evaporation) คือ การที่สารเปลี่ยนสถานะจากของเหลวไปเป็นแก๊ส เมื่ออนุภาคของของเหลวมีพลังงานมาก จนทำให้อนุภาคแยกออกจากกัน เรียกอุณหภูมิที่ทำให้อนุภาคชนะแรงยึดเหนี่ยวของของเหลวได้ว่า จุดเดือด (Boiling Point)
- การแข็งตัว (Freezing) คือ การที่สารเปลี่ยนสถานะจากของเหลวเป็นของแข็ง หรือแก๊สเป็นของแข็ง โดยจะมีการคายพลังงานออกมา ทำให้อนุภาคมีพลังงานในการสั่นน้อย อนุภาคจึงเรียงตัวแบบชิดกันมากขึ้น
- การควบแน่น (Condensation) คือ การที่สารเปลี่ยนสถานะจากแก๊สเป็นของเหลว เช่น กระบวนการเกิดฝน
- การระเหิด (Sublimation) คือ การที่สารเปลี่ยนสถานะจากของแข็งเป็นแก๊ส เช่น การระเหิดของลูกเหม็น การเปลี่ยนแปลงสถานะของน้ำ
- ความร้อนแฝง (Latent heat) คือ พลังงานความร้อนที่ใช้เพื่อเปลี่ยนสถานะ (ดูดพลังงาน) โดยอุณหภูมิไม่เปลี่ยนแปลง มี 2 ประเภท คือ
ความร้อนแฝงของการหลอมเหลว (latent heat of fusion) เป็นพลังงานความร้อนที่ดูดเข้าไป เพื่อเปลี่ยนสถานะจากของแข็งเป็นของเหลว โดยอุณหภูมิคงที่
ความร้อนแฝงของการกลายเป็นไอ (latent heat of vaporization) เป็นพลังงานความร้อนที่ดูดเข้าไปเพื่อเปลี่ยนสถานะจากของเหลวเป็นแก๊ส สารที่เราพบเห็นได้ในชีวิตประจำวันนั้นมีทั้งสารที่อยู่ในสถานะของแข็ง ของเหลว และแก๊ส โดยสารสามารถเปลี่ยนจากสถานะหนึ่งไปเป็นอีกสถานะหนึ่งได้ ซึ่งเกิดจากการเปลี่ยนแปลงพลังงานประเภทดูดหรือคายพลังงาน และสามารถทำให้สารเปลี่ยนกลับมาอยู่ในสถานะเดิมได้อีกด้วย
สมบัติของของแข็ง ของเหลว และก๊าซ
| คุณสมบัติ | ของแข็ง | ของเหลว | แก๊ส |
| ลักษณะเฉพาะ | ทนและต้านทานต่อการเสียรูปทรง | รูปร่างจะเป็นไปตามภาชนะที่บรรจุอยู่ | มีรูปร่างเปลี่ยนแปลงตามขนาดและรูปร่างของภาชนะ |
| การเรียงตัวของอนุภาค | ใกล้ชิดกัน อนุภาคเคลื่อนที่ไม่ได้ | อนุภาคอยู่ห่างกันเล็กน้อย | อนุภาคจะอยู่ห่างกัน ทำให้เคลื่อนที่ได้มาก |
| แรงยึดเหนี่ยวระหว่างอนุภาค | มีค่ามาก | กลาง | มีค่าน้อย |
| ลักษณะการจัดเรียง |  ของแข็ง ของแข็ง |
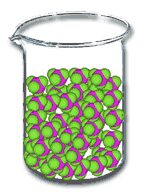 ของเหลว ของเหลว |
|
ตัวอย่างข้อสอบ ของแข็ง ของเหลว แก๊ส
1. สถานะของสสารจะเปลี่ยนแปลงเป็นของเหลวอย่างไร?
ก. มีค่าต่ำกว่าจุดหลอมเหลวของสาร
ข. มีค่าสูงกว่าจุดเดือดของสาร
ค. มีค่าระหว่างจุดหลอมเหลวและจุดเดือดของสาร
ง. มีค่าหน่วงจำเพาะมากกว่าจุดเดือดและจุดหลอมเหลว
2. สถานะของสสารจะเปลี่ยนแปลงเป็นของแข็งอย่างไร?
ก. มีค่าต่ำกว่าจุดหลอมเหลวของสาร
ข. มีค่าสูงกว่าจุดเดือดของสาร
ค. มีค่าระหว่างจุดหลอมเหลวและจุดเดือดสาร
ง. มีค่าหน่วงจำเพาะมากกว่าจุดเดือดและจุดหลอมเหลว
3. การแพร่ของก๊าซเป็นอย่างไร?
ก. กระบวนการที่ก๊าซเคลื่อนที่จากที่หนึ่งไปยังอีกที่หนึ่ง โดยมีการชนกันระหว่างโปรตอนตลอดเวลา
ข. กระบวนการที่ก๊าซเคลื่อนที่จากที่หนึ่งไปยังอีกที่หนึ่ง โดยมีการชนกันระหว่างมวลตลอดเวลา
ค. กระบวนการที่ก๊าซเคลื่อนที่จากที่หนึ่งไปยังอีกที่หนึ่ง โดยมีการชนกันระหว่างอะตอมตลอดเวลา
ง. กระบวนการที่ก๊าซเคลื่อนที่จากที่หนึ่งไปยังอีกที่หนึ่ง โดยมีการชนกันระหว่างโมเลกุลตลอดเวลา
4.สารที่เกิดการระเหิดได คือข้อใด
ก. กำมะถัน การบูร
ข. แอมโมเนีย พิมเสน
ค. ไอโอดีน เกลือแกง
ง. คาร์บอนไดออกไซด์แข็ง แนฟทาลีน
5. เมื่ออุณหภูมิและมวลของก๊าซคงที่ ปริมาตรของก๊าซจะแปรผกผันกับความดัน เป็นไปตามกฎของใคร
ก. ชาร์ลส์
ข. เกย์
ค. บอยส์
ง. ลูสแซก


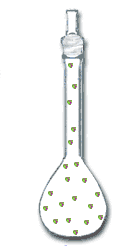 แก๊ส
แก๊ส