สรุปเนื้อหา สมดุลเคมี คืออะไร
สมดุลเคมี คือ สภาวะที่ความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์ไม่เปลี่ยนแปลงอีกแม้เวลาผ่านไป ซึ่งเราจะเรียกว่า “ปฏิกิริยาเคมีนั้นอยู่ในสมดุล (equilibrium)” ทั้งนี้ การดำเนินไปของปฏิริยาไม่ได้สิ้นสุดลง แต่ระบบยังคงมีการเปลี่ยนแปลงอยู่ตลอดเวลา เรียกว่า สมดุลไดนามิก (dynamic equilibrium)
การเปลี่ยนแปลงของระบบดังกล่าว ในทางวิทยาศาสตร์นั้นจะมี 3 รูปแบบ คือ การเปลี่ยนสถานะ, การละลาย และการเกิดปฏิกิริยาเคมี ซึ่งจำแนกเป็น 2 ลักษณะ ได้แก่
1. Inreversible reaction หรือ การเปลี่ยนแปลงที่เกิดขึ้นทางเดียวไม่ย้อนกลับ หมายถึง เมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นอีกสิ่งหนึ่งแล้ว สิ่งที่เกิดขึ้นจากการเปลี่ยนแปลงนี้จะไม่สามารถเปลี่ยนกลับมาสู่ภาวะเดิมได้โดยทันที เช่น การเผาไหม้ของสิ่งต่าง ๆ เราไม่สามารถทำให้สิ่งที่เกิดจากการเผาไหม้ เปลี่ยนกลับไปเป็นสารเดิมเหมือนก่อนการเผาไหม้ได้อีก โดยการเปลี่ยนแปลงลักษณะนี้จะไม่มีภาวะสมดุล
2. Reversible reaction หรือ การเปลี่ยนแปลงที่ผันกลับได้หรือย้อนกลับได้ หมายถึง เมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นสิ่งใหม่แล้ว สิ่งใหม่ที่เกิดขึ้นก็สามารถเปลี่ยนกลับมาเป็นสิ่งเดิมได้ทันที การเปลี่ยนแปลงลักษณะนี้จะเกิดภาวะสมดุลขึ้นได้ เช่น การผลิต ก๊าซแอมโมเนีย (NH3) จากปฏิกิริยาระหว่างก๊าซไฮโดรเจน (H2) กับก๊าซไนโตรเจน (N2) นั่นเอง
หมายเหตุ : ภาวะสมดุล หมายถึง ภาวะที่ระบบมีสมบัติคงที่ หรือภาวะที่สารตั้งต้นและสารผลิตภัณฑ์ทุกชนิดมีปริมาณหรือความเข้มข้นคงที่ หรือภาวะที่อัตราการเปลี่ยนแปลงไปข้างหน้าเท่ากับอัตราการเปลี่ยนแปลงย้อนกลับ
คุณสมบัติของสมดุลเคมี
- สมดุลเคมีจะต้องเกิดในระบบปิดเท่านั้น
- สมดุลจะต้องเกิดการเปลี่ยนแปลงที่ผันกลับได้
- ค่าอัตราการเกิดของปฏิกิริยาไปข้างหน้าจะเท่ากับค่าอัตราการเกิดปฏิกิริยาไปข้างหลัง
- ในทุกๆ ระบบจะมีสารตั้งต้นเหลืออยู่
- ค่าของระบบนั้น ๆ จะคงที่อภาวะที่อัตราการเปลี่ยนแปลงไปข้างหน้าเท่ากับอัตราการเปลี่ยนแปลงย้อนกลับ
หลักของเลอชาเตอลิเอ (Le Chatelier’s Principle)
“เมื่อระบบที่อยู่ในภาวะสมดุลถูกรบกวน ระบบจะเกิดการเปลี่ยนแปลงในทิศทางที่ลดการรบกวนนั้นเพื่อให้เข้าสู่ภาวะสมดุลใหม่อีกครั้ง” ซึ่งการเปลี่ยนแปลงมีดังต่อไปนี้
1. การเปลี่ยนแปลงความเข้มข้นของสาร เป็นการเพิ่มจำนวนโมเลกุลของสารที่เข้าทำปฏิกิริยาให้มีโอกาสชนกันมากขึ้น ทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้น แต่การลดความเข้มข้นของสารเป็นการลดจำนวนโมเลกุลของสารที่เข้าทำปฏิกิริยา ทำให้อัตราการเกิดปฏิกิริยาลดลง ซึ่งจะมีผลต่อภาวะสมดุล คือ
- การเพิ่มความเข้มข้นของสารตั้งต้นสารใดสารหนึ่ง สมดุลจะเลื่อนไปทางขวา และเมื่อเพิ่มความเข้มข้นของสารผลิตภัณฑ์สารใดสารหนึ่ง สมดุลจะเลื่อนไปทางซ้าย
- การลดความเข้มข้นของสารตั้งต้นสารใดสารหนึ่ง สมดุลจะเลื่อนไปทางซ้าย และเมื่อลดความเข้มข้นของสารผลิตภัณฑ์สารใดสารหนึ่ง สมดุลจะเลื่อนไปทางขวา
- สารที่มีสถานะเป็นของแข็ง (s) หรือของเหลวบริสุทธิ์ (l) จะไม่มีผลต่อภาวะสมดุลของระบบ เนื่องจากมีค่าความเข้มข้นคงที่
โดยเมื่อเปลี่ยนความเข้มข้นของสารในระบบ ภาวะสมดุลของระบบก็จะเปลี่ยนแปลงด้วย แต่จะไม่มีผลต่อค่าคงที่สมดุลของระบบ เพราะค่าคงที่สมดุลของระบบนั้นคงที่ แม้จะเพิ่มหรือลดความเข้มข้นของสารตั้งต้นหรือผลิตภัณฑ์ก็ตาม
2. การเปลี่ยนแปลงความดันของระบบ จะมีผลต่อภาวะสมดุลก็ต่อเมื่อเป็นกรณี ดังต่อไปนี้
2.1 ต้องเป็นภาวะสมดุลของระบบที่มีสารอย่างน้อยหนึ่งชนิดเป็นแก๊ส ถ้าเป็นระบบที่มีสารตั้งต้นและสารผลิตภัณฑ์เป็นของแข็งหรือของเหลว การเปลี่ยนแปลงความดันจะไม่มีผลต่อภาวะสมดุลของระบบ
2.2 จำนวนโมลของสารตั้งต้นที่เป็นแก๊ส ต้องไม่เท่ากับจำนวนโมลของสารผลิตภัณฑ์ที่เป็นแก๊ส
โดยการเปลี่ยนแปลงความดันกับภาวะสมดุลของระบบที่มีแก๊สเกี่ยวข้องและจำนวนโมลของแก๊สตั้งต้น และจำนวนโมลของแก๊สผลิตภัณฑ์ต้องไม่เท่ากัน การเปลี่ยนแปลงความดันจะมีผลในการทำให้ภาวะสมดุลเปลี่ยนไป ได้แก่
- เมื่อเพิ่มความดันให้แก่ระบบ (ลดปริมาตรของระบบ) ระบบจะปรับตัวไปในทิศทางลดความดัน โดยการลดจำนวนโมลหรือโมเลกุลของระบบลง เพราะความดันเป็นสัดส่วนโดยตรงกับจำนวนโมลหรือโมเลกุล ดังนั้น การเพิ่มความดันจะทำให้ปฏิกิริยาเกิดไปทางด้านที่มีจำนวนโมลหรือโมเลกุลของแก๊สที่มีจำนวนโมลน้อยกว่าได้ดีขึ้น ที่ภาวะสมดุลใหม่ความเข้มข้นของสารจะต่างจากภาวะสมดุลเดิม
- เมื่อลดความดันให้แก่ระบบ (เพิ่มปริมาตรของระบบ) ระบบจะปรับตัวไปในทิศทางเพิ่มความดัน โดยการเพิ่มจำนวนโมลหรือโมเลกุลของระบบลง เพราะความดันเป็นสัดส่วนโดยตรงกับจำนวนโมลหรือโมเลกุล ดังนั้น การลดความดันจะทำให้ปฏิกิริยาเกิดไปทางด้านที่มีจำนวนโมลหรือโมเลกุลของแก๊สที่มีจำนวนโมลมากกว่าได้ดีขึ้น ที่ภาวะสมดุลใหม่ความเข้มข้นของสารจะต่างจากภาวะสมดุลเดิม
กรณีการเปลี่ยนความดันกับภาวะสมดุลของระบบที่มีแก๊สเข้ามาเกี่ยวข้อง แต่มีจำนวนโมลของสารตั้งต้นที่เป็นแก๊สเท่ากับจำนวนโมลของสารผลิตภัณฑ์ที่เป็นแก๊ส การเพิ่มหรือลดความดันจะไม่มีผลต่อภาวะสมดุลของระบบ เพราะจำนวนโมลของสารตั้งต้นที่เป็นแก๊สเท่ากับจำนวนโมลของสารผลิตภัณฑ์ที่เป็นแก๊สเท่ากัน ดังนั้น ไม่ว่าจะเกิดปฏิกิริยาไปข้างหน้าหรือย้อนกลับ จำนวนโมลของสารที่มีสถานะแก๊สภายในระบบก็ไม่เปลี่ยนแปลง เมื่อเปลี่ยนความดันอัตราการเกิดปฏิกิริยาไปข้างหน้าและย้อนกลับยังคงเท่ากันตลอดเวลา
3. การเปลี่ยนแปลงอุณหภูมิของระบบ มี 2 กรณี ดังนี้
กรณีที่ 1 การเปลี่ยนแปลงอุณหภูมิกับภาวะสมดุลของปฏิกิริยาดูดความร้อน คือ ΔE มีค่าเป็นบวกในปฏิกิริยาดูดความร้อน โดยเมื่อมีการเปลี่ยนแปลงอุณหภูมิจะทำให้ภาวะสมดุลเปลี่ยนไป ดังนี้
- เพิ่มอุณหภูมิระบบปฏิกิริยาจะเกิดไปทางด้านดูดความร้อนมากขึ้น หรือเกิดปฏิกิริยาไปข้างหน้ามากขึ้น
- เมื่อลดอุณหภูมิระบบปฏิกิริยาจะเกิดไปทางด้านคายความร้อนออกมา หรือเกิดปฏิกิริยาย้อนกลับเพื่อเพิ่มอุณหภูมิของระบบขึ้น
กรณีที่ 2 การเปลี่ยนแปลงอุณหภูมิกับภาวะสมดุลของปฏิกิริยาคายความร้อน คือ ΔE มีค่าเป็นลบในปฏิกิริยาคายความร้อน เมื่อมีการเปลี่ยนแปลงอุณหภูมิจะทำให้ภาวะสมดุลเปลี่ยนไป ดังนี้
- เมื่อเพิ่มอุณหภูมิ ระบบปฏิกิริยาจะเกิดไปทางด้านดูดความร้อนหรือเกิดปฏิกิริยาย้อนกลับได้ดีขึ้น เมื่อความร้อนถูกใช้ไปมากขึ้นก็จะทำให้อุณหภูมิลดต่ำลง
- เมื่อลดอุณหภูมิระบบปฏิกิริยาจะเกิดไปทางด้านคายความร้อนหรือเกิดปฏิกิริยาไปข้างหน้าได้ดีขึ้น เมื่อปฏิกิริยาคายความร้อนออกมาก็จะทำให้อุณหภูมิสูงขึ้น
โดยผลของการเปลี่ยนแปลงอุณหภูมินั้น ถ้าเป็นปฏิกิริยาคายความร้อน การลดอุณหภูมิทำให้ผลิตภัณฑ์มากขึ้นและค่าคงที่สมดุลสูงขึ้น แต่ถ้าเป็นปฏิกิริยาดูดความร้อน การลดอุณหภูมิทำให้ได้ผลิตภัณฑ์น้อยลงและค่าคงที่สมดุลลดลง ส่วนการเพิ่มอุณหภูมินั้นจะทำให้ถ้าเป็นปฏิกิริยาคายความร้อน การเพิ่มอุณหภูมิทำให้ผลิตภัณฑ์น้อยลงและค่าคงที่สมดุลลดลง แต่ถ้าเป็นปฏิกิริยาดูดความร้อน การเพิ่มอุณหภูมิทำให้ได้ผลิตภัณฑ์มากขึ้นและค่าคงที่สมดุลเพิ่มขึ้น
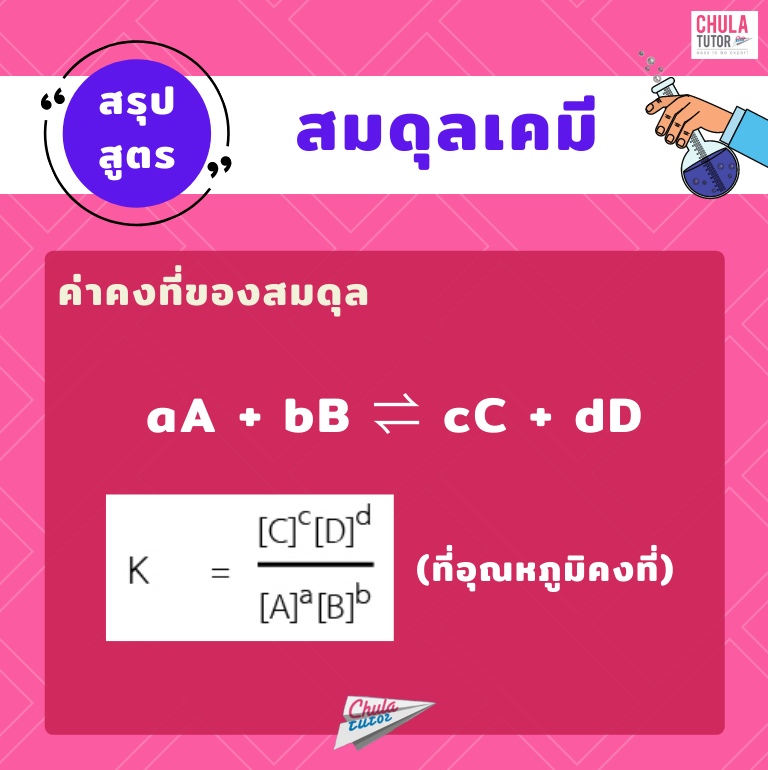
สรุปสูตร สมดุลเคมี

ตัวอย่างข้อสอบ สมดุลเคมี